在新冠疫苗上“起个大早,赶个晚集”的沃森生物又公布新冠疫苗新进展。
7月10日晚间,沃森生物发布公告称,公司与复旦大学、蓝鹊生物共同研发的新冠病毒变异株mRNA疫苗(S蛋白嵌合体)(下称“新冠变异株mRNA疫苗”)在近日获得《Ⅲ期期中分析临床研究报告》。报告显示,该疫苗Ⅲ期临床试验的保护效力主要研究结果已达到规定的评价标准。
 (相关资料图)
(相关资料图)
沃森生物表示,这表明公司新冠变异株mRNA疫苗具备了申请上市许可的关键条件。目前,公司正积极推进该疫苗的上市许可药品注册申请相关工作。
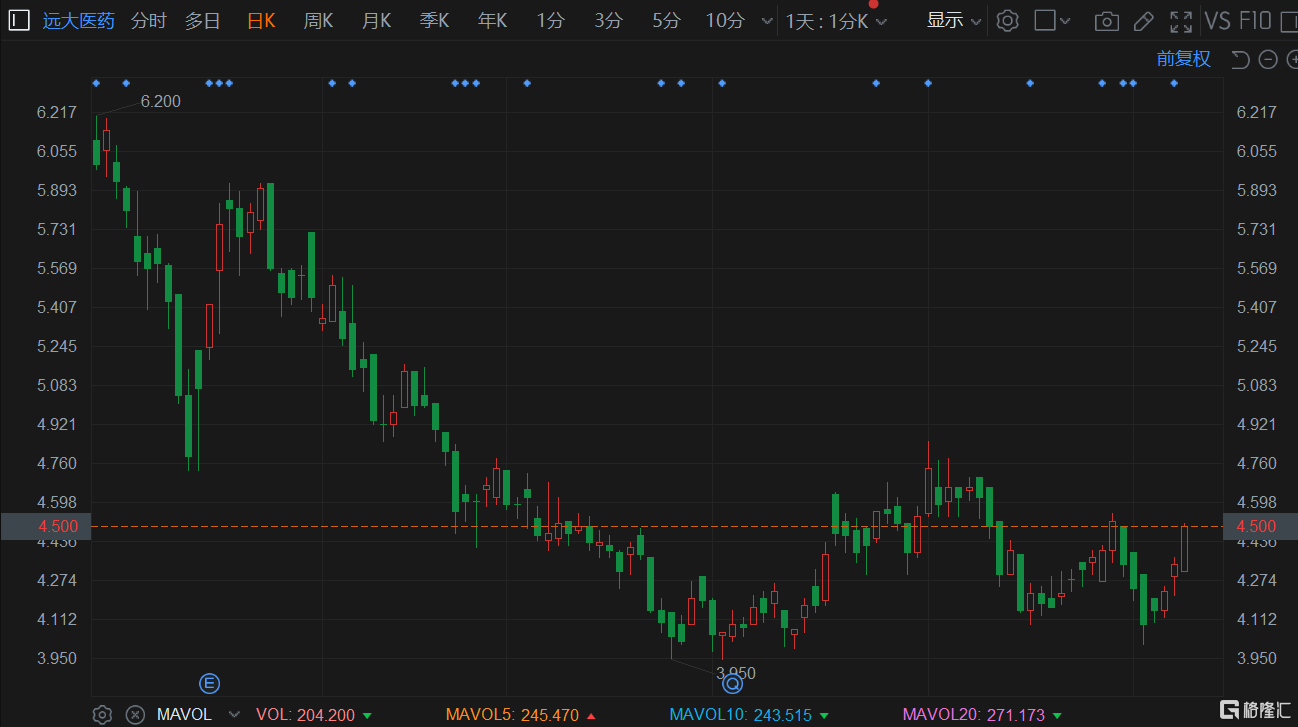
7月11日开盘,沃森生物股价震荡上涨,截至午盘,报26.48元/股,涨1.57%。但相较于两年前高点,公司股价已跌去超七成。
据公司此前公告,该疫苗2022年8月获批进入临床。前述Ⅲ期试验是一项随机、盲法、优效设计、多中心的确证性保护效力临床试验,用于评价该疫苗在已完成3剂新冠灭活疫苗接种的18岁及以上人群中,序贯加强接种1剂后的保护效力、安全性和免疫原性。研究结果显示,该疫苗在目标人群中具有良好的保护效力和安全性。
但需要注意的是,目前,国内已获批(含紧急获批)的新冠疫苗已有约15款。其中包括来自石药集团的首款新冠mRNA疫苗(SYS6006)、来自威斯克生物的首款XBB变异株新冠疫苗等。同时,新冠疫情逐渐远去也使新冠疫苗总体需求量走低,产品商业化前景并不乐观。
沃森生物之所为被认为在新冠疫苗研发上表现不佳,还因为其布局颇多,但产出很少。
2020年6月、2021年5月和6月,沃森生物与艾博生物研发的新冠mRNA疫苗、与清华及天津医科大学合作研发的新冠腺病毒载体疫苗、上海泽润的重组新冠疫苗(CHO细胞)分别获得临床批件。在变异株方面,除了前述新冠变异株mRNA疫苗,沃森生物还有子公司上海泽润的重组新冠病毒变异株疫苗(CHO细胞)。
但据公司2022年年报,前述管线中,仅有新冠mRNA疫苗在2022年9月获得印尼EUA(紧急使用授权)。除前述新冠变异株mRNA疫苗外,剩下三条管线还处于临床Ⅰ期或Ⅱ阶段。
不过,沃森生物也借助新冠疫苗切入了如今大热的mRNA疫苗领域,逐步构建起mRNA疫苗技术平台和研发团队。
当下,随着在mRNA序列、递送载体、放大生产等方面实现技术突破,mRNA技术有望带来生物医药行业新一轮的技术变革已成为业界共识。沃森生物表示,除新冠mRNA疫苗外,公司还与合作方共同研发了带状疱疹mRNA疫苗、呼吸道合胞病毒mRNA疫苗和流感病毒mRNA疫苗,目前均在持续推进中。
但当下,沃森生物身上最引人注目的标签还是双价HPV疫苗和13价肺炎结合疫苗(PCV13)。这两款产品都是非免疫规划类的大品种。具体而言,沃森生物的PCV13(商品名:沃安欣)于2020年1月获批上市,成为国产首款、世界第二款PCV13疫苗,结束了辉瑞独占四年国内市场的情况。目前,国内PCV13疫苗获批的公司有辉瑞、沃森、康泰三家。
2022年,沃安欣获批签发772.1万剂,同比增长55.96%。同期,康泰生物PCV13疫苗批签发496.78万剂,同比增长1089.61%。
沃森生物的双价HPV疫苗(商品名:沃泽惠)则在2022年3月获批上市,成为第二款国产双价HPV疫苗。目前国内HPV疫苗市场中共有5款产品,分别是默沙东的四价、九价疫苗,GKS(葛兰素史克)、万泰和沃森的双价疫苗。
上市首年,沃泽惠获批签发498.05万剂。同期,万泰生物双价HPV批签发近3000万支,销售量超2500万支。
此外,除了自费接种,HPV疫苗领域的一个显著趋势是其成为政府补贴及公共卫生力量参与的公益品种。公司7月6日公布的调研活动记录显示,今年6月,沃森生物以3.2亿元中标江西省2023年HPV疫苗采购项目。同时,公司表示,HPV疫苗国内市场渗透率较低,并且双价HPV产品性价比较高,预计未来3-5年仍有较大的市场需求。
另外,HPV疫苗的更大看点在国产九价上。丁香园insight数据库显示,目前,沃森生物、万泰生物、瑞科生物、康乐卫士、博唯生物等5家企业的九价HPV疫苗均已进入III期临床试验。其中,瑞科生物、康乐卫分别拟于2025年、2026年底提交上市申请。而沃森生物目前进度并不领先,未来也将面临激烈竞争。
业绩方面,2022年,公司营收、归母净利润、扣非净利润分别为50.86亿元、7.29亿元、8.59亿元,分别同比上涨46.89%、70.35%、45.33%。今年第一季度,公司营收、归母净利润、扣非净利润分别为8.33亿元、1.72亿元、1.34亿元,分别同比上涨27.04%、345.34%、37.64%。
标签: